| section Accueil
Production, Amateur Radio amateur avions de modèle, fusée Utile, divertissant |
maître furtif
électronique physique de la technologie invention |
espace Mystery
Mystères de la Terre Secrets de l'océan infiltration section Carte |
|
| Utilisation de matériel est autorisé à titre de référence (pour les sites - hyperliens) | |||
PROCÉDÉ DE REVÊTEMENT GALVANIQUE
Ilya Loskutov
![]()
Travailler avec le placage de cuivre électrolytique a ses propres particularités. Pour commencer avec des revêtements de cuivre des lignes directrices d'application directe: pour éviter la récupération de surface de pièces chargées dans l'électrolyte de contact en cuivre ne peut être mis sous tension, sinon une forte adhérence de la boue à la matière de base ne sont pas fournies. Un rôle très important dans cette situation est également titulaire d'une densité de courant initiale. En effet, à très haute intensité de courant également formé si épais, mais les dépôts grossièrement cristallins qui sera par la suite, dans certains cas, pour produire des revêtements ondulés ou noueux épaisseur imprévisible. Au courant extrêmement faible vitesse de placage de densité de l'éducation sera en retard sur la vitesse de libération du contact et du cuivre choisi, ce qui provoque ensuite le pelage du revêtement.
Chaque espèce a ses propres électrolytes de placage de cuivre, la densité de courant optimale strictement défini. Dans la pratique, la densité de courant optimale est choisie en fonction de l'aspect du revêtement et la vitesse de son éducation. Si vous avez une relativement faible compétence, qui est acquise très rapidement, comme le cours de l'outil de gestion de processus fournit un revêtement de très haute qualité. Lorsque le processus mode galvanoplastie correctement sélectionné, la couche de placage de cuivre a une couleur solide, une structure fine uniforme. En imposant des densités de courant excessives obtenues couche de cuivre à gros grains du métal sont également caractéristique rouge brique. A propos de finition défaut est généralement exprimée qui vient couvercle "de podgar". L'excès de courant en plus podgara occurrence peut conduire à la passivation des anodes.
Dans le même temps sur la surface de celle-ci il y a un détachage blanc de neige bleu verdâtre ou brun, facilement effaçable revêtement, ce qui empêche le processus normal de dissolution du métal. Ainsi, sur la couverture de soulever les sels de cuivre usés contenus dans l'électrolyte, ce qui conduit à l'instabilité de sa composition chimique.
Ainsi, la source est nécessaire pour préparer un électrolyte. 1 litre d'électrolyte nécessaire:
Le sulfate de cuivre - 60 g;
Le sucre raffiné - 90 g;
L' hydroxyde de sodium - 45 g;
Alcool - 5.10 ml.
l' électrolyte préparé selon une séquence stricte: sulfate de cuivre soluble dans 200-300 ml d'eau, le sucre est ajouté. Séparément, 250 ml d'hydroxyde de sodium soluble dans l'eau. Ensuite, une solution d'hydroxyde de sodium en petites portions sous agitation constante, on ajoute une solution de sulfate de cuivre avec du sucre. Ensuite , l' eau est ajoutée jusqu'à obtenir 1 litre de solution. Pour choisir la dissolution des composants chauffer l'eau de meilleure façon de 35-40 degrés de température. Comme un bain mozhnoispolzovat bancaire ordinaire placage. Après la préparation de l'électrolyte principal on ajoute 5-10 ml d'alcool. La présence de l'alcool améliore la qualité du cuivre déposé, ce qui rend la structure de revêtement plus dense réduit aussi grandement le grain du métal. électrolyte Fini a une riche peinture bleu-vert sombre (un mozhnouvidet de peinture seulement à un très petit nombre de l'électrolyte sur le fond et la lumière, mais il semble que ce soit sur le noir).
Ces proportions sont tirées du chapitre "Les méthodes chimiques et électrochimiques des parties de traitement" du livre "sudomodelizma ABC" (Dregalin AN Polygon C.-P. 2003).
Mais l'idée que mozhnoeksperimentirovat composition d'électrolyte.
Pour la préparation de l'électrolyte est fortement recommandé d'utiliser l'eau non ordinaire du robinet, mais distillat. En outre , il est préférable de ne pas appliquer le sulfate de cuivre technique (engrais), mais chimiquement propre de sulfate de cuivre cristallin (le même bluestone) de qualification d'au moins 4.
De tels produits chimiques disponibles dans le commerce. Caustic mozhnonayti de soude là.
l'entretien de l'électrolyte est également question très importante. Avec le passage de la boue des pores formés, altère de façon significative la performance de la composition de l'électrolyte. Par conséquent, vous devez périodiquement passer la solution à travers le filtre de 2 couches de tissu avec rembourrage entre le tissu mince. La même chose est recommandé de préparer l'électrolyte à nouveau plus tard. Le pauses bain (la banque) doit être fermé couvercle étanche pour éviter de tomber à la particule de poussière, la poussière, la vapeur d'eau (et, par conséquent, une violation de la concentration des composants).
Ensuite, nous recueillons des circuits. L'électrode est reliée à l'effet "+" (positif) de la feuille de cuivre, pour les pièces de même coloration enroulées dans un cylindre (voir. Figures). L'électrode est connectée à la "-" (cathode) est relié à la pièce à revêtir. Pour supprimer les paramètres du circuit électrique ampèremètre mozhnovklyuchit et voltmètre. Le schéma de principe est représenté sur la Fig.
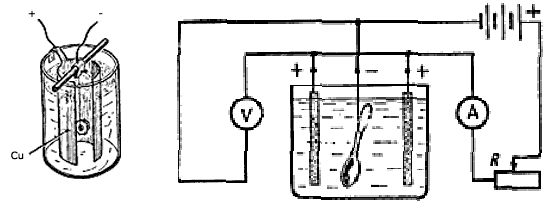
Conduite connexion de circuit
|
Cathode - détail peint |
anode |

À quoi il ressemble dans la pratique
Pour plus de détails sur la couche de revêtement de cuivre nécessaire pour fournir la densité de courant désirée d'environ 0,5 (1,2) A / dm 2 (dans diverses sources différentes). Là encore, la même densité de courant dépend de plusieurs facteurs tels que la taille des pièces, la composition et la température de l'électrolyte, des réactions pureté (pureté de l'eau et des réactifs organiques), le temps de réaction. Par conséquent, le plus probable, tout le monde devra prendre l'ampérage en utilisant la résistance variable. A cet effet, un ressort dans le circuit entre le courant nécessaire d'anode pour fournir une résistance variable (résistance ou une résistance de coupe, ce qui est préférable). Comme chaque courant constant de printemps, vous pouvez utiliser un ressort avec une tension de sortie de courant jusqu'à 10 volts. Dans cet exemple, nous utilisons l'ancienne façon de faire payer «Philips» téléphone mobile avec les caractéristiques de sortie de la 4.2 V 770 mA.
La densité de courant est calculée selon la formule: I = I / S
dans lequel la chambre: I - alimentation en courant; S - la surface totale des pièces peintes.
Avec la force actuelle plus ou moins clair - il est réglé les paramètres de sortie de la source de courant et la résistance variable.
Nous trouvons la surface totale des pièces peintes. Considérez précédemment composé 24 -funtovoy-carronades pistolet pour corvette "Olivutsa".
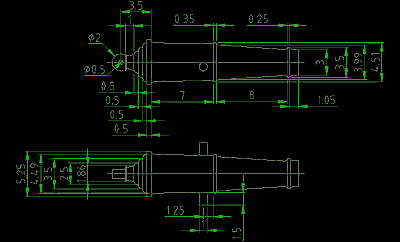
Dans ce cas, une figure complexe du pistolet se compose de quelques figures simples - cônes et des cylindres tronqués. Mais pour compter avec précision la surface, il est difficile et n'a pas besoin de - vous ne pouvez l'imaginer sous la forme d'un cylindre avec un diamètre moyen et calculer la superficie approximative, qui sera suffisant pour notre travail.
Mais mozhnotakzhe produisent des estimations plus précises, brisant l'article sur des primitives géométriques sont également compte tenu de la surface externe de chaque zone.
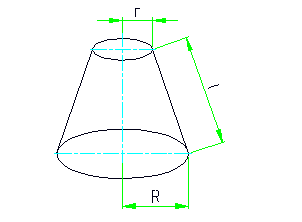
Surface totale du cône est donnée par: S = 3,14 * (R 2 + r 2 + l * (R + r) );
Zone Cône: S = 3,14 * l * ( R + r);
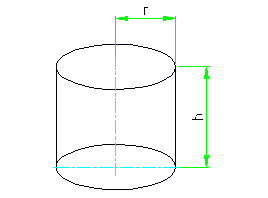
Surface totale du cylindre: S = 2 * 3,14 * r * (r + h);
La superficie de la surface latérale du cylindre: S = 2 * 3,14 * r * h;
|
|
Substituer les dimensions de la formule d' acquérir des parties de notre zone de 0,03 dm 2.
En conséquence , le courant nécessaire de puissance: I = i * S = 0,5 ( la densité de courant nécessaire) * 0,03 (zone détails) = 15 mA
Et par conséquent , nous gagnons la résistance de boucle requise: R = U / I = 4,2V / 15mA = 280 ohms
Mais il ne prend pas en compte la résistance interne de l'électrolyte, de sorte que dans la pratique, le compteur externe doit être inférieure estimée. Dans mon cas, les caractéristiques optimales du circuit sont activées: la source de courant mentionné ci - dessus, la résistance dans le circuit d'anode égale à 220 ohms. Il est temps de teindre les parties de 17 minutes. Tel qu'il est utilisé dans le bain de la fiole en verre de placage sous - capacité bébé d'alimentation de 150 ml, la surface de la plaque de cuivre (anode) = 49 cm 2, la température de la chambre d'électrolyte (18 à 22 0 C).
Si vous ne disposez pas d' un ampèremètre et a une résistance variable, indéfinissables avec précision , même si jusqu'à 10 ohms, puis oeil mozhnoopredelit ampérage nécessaire comme suit: à très haute intensité à l'hydrogène de la cathode est libérée sous forme de bulles bien visibles (il y a un soi-disant "ébullition »). Ces bulles empêchent le dépôt de cuivre sur l'anode. Cet article est recouvert d'une patine brun foncé, facile à laver ses doigts. Par conséquent, il est nécessaire de diminuer le courant (augmenter la résistance) jusqu'à ce que le dégagement d'hydrogène qui ne soit pas clairement visible (hydrogène est libéré à un ampérage), à savoir comme si la seule bulle ne devient pas visible, vous pouvez séjourner dans cet ampérage et le changer (si nécessaire), en se concentrant sur les parties externes signifient.
Après que si l'élément est retiré de l'électrolyte, il doit être lavé très soigneusement à l'eau courante. En conséquence, nous obtenons une pièce colorée de couleur cuivre mat.
Autres informations sur la négociation des paillettes broient soigneusement avec un chiffon avec de la pâte GOI ou de la petite craie (poudre de dent). Encore une fois, laver (laver les restes de la craie et coller GOI) et d' acquérir le résultat final.
Quelques conseils sur la qualité de la surface des pièces peintes. Pour un dépôt plus uniforme des pièces en cuivre doit être lisse et dégraissée. Il est connu que dans la pièce de coulée a une surface microporeuse - que de ces micropores ont également besoin de se débarrasser de. Si le matériau de coulée est ramollie (par exemple l'étain), cela peut être fait en utilisant une aiguille en acier, le laminage ou provolakivaya le long de ses parties, comme le montre la figure.

Enfin, penser, devrait décrire les perspectives de cette technologie. Grâce à cette technologie pour produire du cuivre placage mozhnoskhozhe pièces creuses en cuivre, par exemple, la cloche du navire. Pour cette mozhnosdelat de toutes les cloches blanches matériau fusible également de couverture exactement similaire avec le cuivre (mais d'épaisseur). L'étape suivante consiste méticuleuses découpes de matériau de fusion. Mais sûrement la même chose, en même temps besoin d' une couche pleine de cuivre comme les pores qu'il tiendra beaucoup plus que 17 minutes.
Cette technologie mozhnoispolzovat et pour couvrir différentes décorations sculptées en or, en cuivre ou en bronze. Dans ce processus, le mozhnodobitsya galvanisant presque toutes les couleurs - seulement besoin d'expérimenter avec la composition de l'électrolyte et l'intensité du courant.
Créateur: Ilya Loskutov





Commentaires
Commentant, gardez à l' esprit que le contenu et le ton de vos messages peuvent blesser les sentiments des gens réels, montrer du respect et de la tolérance à ses interlocuteurs, même si vous ne partagez pas leur avis, votre comportement en termes de liberté d'expression et de l' anonymat offert par Internet, est en train de changer non seulement virtuel, mais dans le monde réel. Tous les commentaires sont cachés à l'index, le contrôle anti - spam.