| section Accueil
Production, Amateur Radio amateur avions de modèle, fusée Utile, divertissant |
maître furtif
électronique physique de la technologie invention |
espace Mystery
Mystères de la Terre Secrets de l'océan infiltration section Carte |
|
| Utilisation de matériel est autorisé à titre de référence (pour les sites - hyperliens) | |||
Navigation: => |
Accueil / Produits Brevets / Dans la section du catalogue / retour / |
|
invention
Fédération de Russie Patent RU2040565
![]()
MÉTHODE D'EXTRACTION DE SOLUTIONS rubidium composition chimique complexe
Nom de l'inventeur: Glushankova IS;. Kolesov SA. Balandin LV. Volkhin VV
Le nom du titulaire du brevet: Université technique d' Etat de Perm
Adresse de correspondance:
Date de début du brevet: 19.02.1991
Utilisation de: obtention d'un rares sels de métaux alcalins. Rubidium l'invention à partir de solutions de composition chimique complexe adsorbé à sorbants ferrocyanure de sorbant traité éliminant Rb dans la solution en deux étapes: dans la première solution de l'étape de chlore dans le solvant organique contenant du fluor, qui est utilisé comme fluide fluoré F-12, F-13 une seconde solution aqueuse concentrée d'alcools monofonctionnels, qui tel qu'il est utilisé avec une concentration d'éthanol de 85 à 96% vol. isopropyle ou une concentration de 80 à 88% en volume. le chlorure de rubidium obtenu par évaporation de la solution, l'élimination par distillation des alcools et leur utilisation répétée.
DESCRIPTION DE L'INVENTION
L'invention concerne des procédés de préparation de sels de métaux alcalins de rares et peuvent être utilisés dans la technologie des sels de rubidium.
Procédé de sorption connu d'extraire des ions de rubidium à partir de solutions de composition chimique complexe riche en sels de métaux alcalins et de métaux alcalino-terreux, en utilisant comme sorbants ferrocyanure (hexacyanoferrates) des métaux de transition Ni (II), Cu (II), suivie d'une désorption des ions de rubidium et de traitement des éluats des procédés connus ( par évaporation ou par précipitation composés peu solubles) [1,2]
On sait que les ferrocyanures métalliques de transition sélectivement des ions rubidium retirés des solutions de compositions différentes, avec des facteurs de séparation élevés obtenus Rb + et les ions K +, Rb + et Na + (K p 10 Mars) [2.3]
Cependant, l' utilisation généralisée de la technologie d'adsorption des sels de rubidium limitées par l'absence de méthode suffisamment efficace de désorption des ions Rb + du ferrocyanure, qui en même temps, il est difficile de produire des sels de rubidium de qualités réactives.
Ion connu des méthodes d'échange de désorption Rb + et les autres ions de métaux alcalins , des sorbants ferrocyanure en utilisant le chlorure ou le nitrate d' ammonium [3] Cependant, ces méthodes sont inefficaces. Des procédés connus et désorption des ions de métaux alcalins et le thallium (I) de la composition à l'aide ferrocyanure oxydant. Comme agent oxydant, on utilise des solutions très concentrées d'acide nitrique ou d'acide sulfurique [4]
Le plus proche de la solution technique proposée (prototype) est la méthode d'isolement de rubidium, le rubidium sorption comprenant des sorbants ferrocyanure pour le traitement ultérieur et l'extraction sorbant avec une solution de rubidium, le chlorure de rubidium pour donner une solution [3]
Cependant, en raison des éluats de désorption générer des quantités importantes de faible concentration de rubidium, ce qui entraîne des coûts d'énergie élevés dans les solutions de traitement pour produire du chlorure de rubidium. En outre, pour obtenir un sel nécessaire avant la séparation des ions Rb + et suffisamment purs de Na +, et ce qui complique la technologie.
Le but de l'invention augmentent le taux d'extraction de rubidium dans le produit et de réduire les coûts énergétiques.
L'objectif est atteint grâce à une désorption des ions de ferrocyanure Rb en traitant ce dernier avec une solution de chlore dans un solvant organique. le chlorure de rubidium libéré dans la solution au moyen de solutions aqueuses concentrées de faible point d'ébullition des alcools monohydriques avec évaporation ultérieure et le rendement de distillation de solutions hautement concentrée de sel de rubidium. alcool distillé est utilisé pour la désorption à nouveau sorbant rubidium dans le fonctionnement du cycle suivant.
Comme solvant, le liquide organofluoré de chlore choisi, par exemple F-12, F-13, qui répondent aux exigences suivantes: faible volatilité, inflammabilité, inertie chimique élevée (résistance aux oxydants), une faible solubilité dans l'eau et les alcools, non toxique. des liquides de saturation chloro fluoro-organiques a été effectuée d'une manière connue en faisant passer du chlore gazeux à travers le solvant. A température ambiante, la concentration du chlore dans le F-12 équilibre, le F-13 est de 0,5 à 0,7 M. La concentration élevée de chlore dans la solution réduit significativement le volume d'éluant nécessaire pour la désorption des ions de ferrocyanure de rubidium. Extrait isolé à partir de la composition de chlorure de rubidium sorbant est porté par des solutions d'eau ou d'alcool. le chlorure de rubidium est dissous dans les alcools monofonctionnels (méthyle, éthyle, propyle, isopropyle, etc.) et leurs solutions aqueuses.
Afin de réduire la consommation d'énergie pour l'évaporation des éluats est proposé de procéder à désorption solutions RbCl de chlorure de rubidium de l'alcool isopropylique ou éthyle, qui sont choisis sur la base d'un point d'ébullition bas et une faible toxicité. le coût de la chaleur d'obtenir 1 kg de sel de rubidium par évaporation des éluats a été calculé selon la formule suivante

Exemple 1. 5 g de sorbant ferrocyanure, la formule brute est K 0,92 Cu 1,54 [Fe (CN)6] 4,9 SiO 2 a été chargé dans la colonne échangeuse d'ions ayant un diamètre de 0,7 cm et une hauteur de 20 cm, et la couche de matière de sorption a été réalisée sorption Rb modèle de solution contenant des chlorures de potassium et de rubidium , le rapport de Rb +: K + 1: 150 et Rb concentration 0,2-0,25 g / l (2,34 10 -3 10 -3 -2,9 ..) à une vitesse solution passant 2-3 volumes de colonne / h. La capacité totale de l'adsorbant par ions Rb échangeuse d'ions a été 0,82-0,88 mmol / g de sorbant. Les coefficients de la séparation des ions Rb + K + 5 atteint. 10 mars5,5. 10 mars.
Pour rubidium salez qualifications réactives détenus élection désorption de K + et Rb +.
Désorption des ions ferrocyanure de potassium de la solution a été réalisée avec de l'acide chlorhydrique 1 M. En faisant passer 8-10 volumes de colonne (KO) éluant obtenu désorption presque complète de K + et l'extraction des ions Rb est inférieur à 1%
Mesurer la concentration d'ions de rubidium et de potassium a été effectuée par la méthode d'absorption atomique.
Pour éliminer le Rb à partir du dernier sorbant traité avec une solution 0,7 M de chlore dans P-13 fluoré liquide en le faisant passer à travers une colonne échangeuse d'ions à un débit de 3-4 Co / h. oxydation sorbant Exhaustivité contrôlée par la consommation de chlore. La concentration du chlore dans un solvant organique est mesurée par titrimétrie. Pour l'oxydation complète de CO 2 nécessaire solution de chlore ferrocyanure. Ensuite, à travers le sorbant pour extraire le chlorure de rubidium, l'eau formée a été passée à une vitesse de 5,4 CO / h. Des échantillons ont été prélevés pour l'analyse des fractions d'éluat de 20 ml. Pour la désorption complète des ions Rb requis 8 KO. La première fraction d'éluat avec la concentration la plus élevée du composant principal est transformé en produit fini, les fractions suivantes ont été recueillies et réutilisées pour le décapage des ions Rb dans le cycle suivant.
Après avoir terminé l'agent de sorption désorption lavé 03.02 KO l'eau, régénéré, de manière connue et utilisée dans le prochain cycle de sorption rubidium [4]
La concentration en chlorure de rubidium dans l'éluat de la première fraction et le coût de sa chaleur à évaporation dans le tableau.
Exemple 2. des ions Rb + et sorption des ions K + désorption effectués conformément à l' exemple 1. Pour convertir RbCl dans l'éluat à travers la colonne avec la concentration d'alcool éthylique de 96 vol. Pour la désorption complète RbCl a 12 KOs alcool. RbCl Concentration en éluat de la première fraction et le coût approximatif de la chaleur à 1 kg de sel indiquées dans le tableau rubidium.
Exemple 3. des ions Rb + et sorption des ions K + désorption effectués conformément à l' exemple 1. Le sorbant est ensuite traité avec 0,4 M de solution de chlore dans un liquide fluoré F-13. débit Eluant nécessaire pour une oxydation complète du sorbant, était 3-4 KO. Le sorbant est ensuite traitée avec une solution d'alcool éthylique à une concentration de 84. Pour une sélection complète RbCl raté 8 KO éluant. les résultats de désorption sont présentés dans le tableau.
Exemple 4. des ions Rb + et sorption des ions K + désorption réalisées selon l'exemple 1. Le sorbant est ensuite traitée avec une solution 0,5 M de chlore dans P-13. Une solution d'éluant est 2-3 KO. Ensuite, l'extrait RbCl est passé à travers une colonne de 70. une solution d'éthanol en une quantité de 6 DA. RbcL par les résultats de désorption sont indiqués dans le tableau.
Exemple 5. Sorption des ions Rb +, K +, des ions de désorption, la solution de traitement au chlore adsorbant réalisées selon l'exemple 1. Désorption RbCl a été réalisée avec 100% d' alcool isopropylique pour une extraction complète a 12 KO RbCl alcool. Les résultats expérimentaux sont présentés dans le tableau.
Exemple 6. des ions de sorption Rb +, des ions K +, de désorption, une solution de traitement au chlore adsorbant réalisées selon l'exemple 1. Pour la désorption RbCl passé à travers le sorbant 10 avec une concentration en CO de l' alcool isopropylique à 95% Les résultats expérimentaux sont présentés dans le tableau.
Exemple 7. des ions Rb + et sorption des ions K + désorption réalisées selon l'exemple 1. Le sorbant est ensuite traitée avec une solution 0,5 M de chlore dans un liquide fluoré F-12. Pour l'oxydation complète de sorbant requis 3 KOs éluat. Pour supprimer RbCl passé à travers la colonne 88 environ 8 KOs. une solution d'alcool isopropylique. Les résultats expérimentaux sont présentés dans le tableau.
Exemple 8. des ions de sorption Rb +, K + des ions chlore désorption et le traitement de l'adsorbant a été réalisée selon l'exemple 1. Ensuite colonne d'extraction RbCl passée à travers le 66 CO 80 vol. une solution d'alcool isopropylique.
Les résultats expérimentaux sont présentés dans le tableau.
Exemple 9. ions sorption de rubidium, les ions K +, désorption et passé le traitement sorbant de chlore selon l'exemple 1. Ensuite, pour extraire passer dans la colonne RbCl 4 KO 75 vol. une solution d'alcool isopropylique. Les résultats expérimentaux sont présentés dans le tableau.
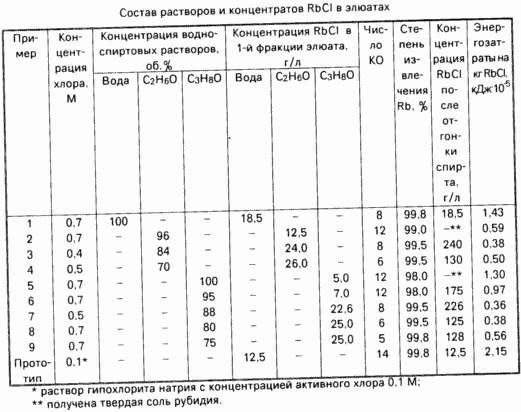
A partir des données du tableau montre que le procédé de désorption à partir des ions de rubidium et sorbants ferrocyanure éluats de sel préparation de rubidium par un traitement d'évaporation est plus effectuée de façon appropriée la solution de ferrocyanure 0,5-0,7 M de chlore dans une fluoré F-12 liquide ou F-13, puis libéré de la phase de sorption chlorure de rubidium extrait 96-85% solution d'éthanol ou d'environ 88-80. de l'alcool isopropylique.
L'utilisation d'eau pour l'extraction de la composition de sorbant chlorure de rubidium est peu pratique en raison de la consommation d'énergie élevée dans la préparation du sel par évaporation de solutions aqueuses.
Utiliser des solutions moins concentrées d'ions rubidium alcools de désorption réduit la concentration de l'ion dans la solution obtenue après élimination par distillation de l'alcool et augmente la consommation d'énergie au cours de leur traitement. L'utilisation de solutions plus concentrées d'alcools inefficaces en raison de rubidium sels peu solubles qui s'y trouvent.
La méthode proposée pour la récupération de rubidium composition complexe de la solution permet la comparaison avec le prototype d'augmenter la concentration de 1,5-2 de rubidium dans les éluats et de réduire la consommation d'énergie dans le sel de rubidium de 3-6.
REVENDICATIONS
1. METHODE DE composition chimique complexe solution d'extraction de rubidium comprenant rubidium sorption sorbants ferrocyanure pour le traitement ultérieur et l'extraction sorbant avec une solution de chlorure de rubidium, le rubidium à obtenir, caractérisé en ce que, afin d'augmenter le degré d'extraction d'un produit de rubidium et de réduire la consommation d'énergie, le traitement ferrocyanure sorbant est réalisée en deux étapes, la première étape avec une solution de chlore dans le solvant organique contenant du fluor, la deuxième solution aqueuse concentrée d'alcools monohydriques avec evaporation ultérieure et la distillation de réutilisation.
2. Procédé selon la revendication 1, dans lequel le liquide fluoré est utilisé dans le F-12, F-13, en tant que solvant organique contenant du fluor.
3. Procédé selon la revendication 1, caractérisé en ce que les alcools monohydriques sont utilisés avec une concentration d'éthanol de 85 à 96. ou l'isopropanol à la concentration de 80-88.
Version imprimable
Date de publication 15.03.2007gg




Commentaires
Commentant, gardez à l' esprit que le contenu et le ton de vos messages peuvent blesser les sentiments des gens réels, montrer du respect et de la tolérance à ses interlocuteurs, même si vous ne partagez pas leur avis, votre comportement en termes de liberté d'expression et de l' anonymat offert par Internet, est en train de changer non seulement virtuel, mais dans le monde réel. Tous les commentaires sont cachés à l'index, le contrôle anti - spam.