|
section Accueil
Production, Amateur Radio amateur avions de modèle, fusée Utile, divertissant |
maître furtif
électronique physique de la technologie invention |
espace Mystery
Mystères de la Terre Secrets de l'océan infiltration section Carte |
|
| Utilisation de matériel est autorisé à titre de référence (pour les sites - hyperliens) | |||
Navigation: => |
Accueil / Produits Brevets / Dans la section du catalogue / retour / |
|
invention
Fédération de Russie Patent RU2114926
![]()
Lixiviation d'or avec le
des composés aromatiques hétérocycliques azotés et de soufre
Nom de l'inventeur: Kristyansdottir Sigraydyu Soul (US); Jeffrey Scott Thompson (US)
Le nom du titulaire du brevet: E.I.Dyu Pont De Nemurs and Company (Etats - Unis)
Adresse de correspondance:
Date de début du brevet: 06.10.1994
Le procédé peut être utilisé dans des procédés nécessitant la dissolution de l'or métallique, en particulier pour la récupération hydrométallurgique de l'or à partir du minerai. Le processus de dissolution est effectuée dans un système d'agent de lixiviation de l'or métallique contenant un ligand et d'un oxydant, où la solubilité de l'or est améliorée par l'addition de composés aromatiques contenant un atome d'azote ou de soufre cyclique. lessivage d'or est réalisée en utilisant des fluides moins corrosifs sans pertes significatives dans le taux de dissolution du métal.
DESCRIPTION DE L'INVENTION
L'invention se rapporte à la dissolution de la solution métallique de lixiviation de l' or en particulier pour l'extraction hydrométallurgique de l' or à partir du minerai. En particulier, elle concerne le domaine de la lixiviation de l' or, où le lessivage du ligand et de l' oxydant sont utilisés, comme un composé aromatique activateur dissolution hétérocyclique contenant un atome d'azote cyclique ou de soufre.
De nombreuses opérations nécessitent la dissolution de l'or, par exemple l'extraction de métaux à partir de minerais d'or contenant de petites quantités de métal, la récupération de l'or à partir de matières or plaqué, ainsi que la préparation de composés d'or solubles pour être utilisés dans la production des catalyseurs. Cependant, le métal or est remarquable pour sa résistance à la dissolution et la réaction chimique. Par exemple, l'or se dissout dans une solution aqueuse uniquement si la solution contient un ligand approprié ou un agent de liaison pour l'or plus un agent oxydant. Aucun des composants individuels ne sont pas efficaces. Cette combinaison de ligand et de l'oxydant est appelé système de lixiviation.
Au cours du siècle dernier pour l'or, il a été proposé et utilisé un certain nombre de systèmes lixiviant, principalement pour les applications minières. Le système le plus largement utilisé est une combinaison de cyanure de sodium en tant que ligand avec l'air (oxygène) comme oxydant, principalement en raison de l'économie et de simplicité processus. D'autres systèmes de ligand / oxydant importants sont la thiourée et du thiocyanate avec des ions ferriques, et de thiosulfate de sodium avec de l'air, du cuivre (II) et de l'ammoniac, du chlorure de sodium et d'hypochlorite de sodium, le bromure de sodium et le brome, ainsi que, et de nombreux autres systèmes. Chimie de ces et d'autres systèmes de lixiviant alternatif est décrit dans un article de JB Hiskey et VPAtluri, traitement des minerais et métallurgie extractive Review, 4,95-134 (1988). Sélection d'un système lixiviant particulier dépend de divers facteurs, y compris le coût des composants, la sécurité, l'environnement et la corrosion des équipements. Pour les opérations minières, le principal facteur dans le choix d'un système de lixiviant particulier est souvent la facilité de séparation des impuretés associées à l'or dans le minerai.
On sait que certains cations métalliques divalents tels que le plomb, le mercure, le thallium et le bismuth accélérer la dissolution de l'or dans les solutions de cyanure. Le mécanisme d'action est inconnu, bien que la dépolarisation suggèrent que la surface d'or et la prévention de passivation de la surface d'or. L'utilisation de ces métaux est indésirable. Si elles se distinguent par l'or, à l'avenir, il peut nécessiter un traitement coûteux. Si une partie de ces ions métalliques hautement toxiques est piégé avec les résidus du traitement du minerai, ils vont créer un risque sérieux et à long terme de la pollution environnementale.
Améliorer l'un des systèmes lixiviant généralement utilisés serait d'une grande valeur, en particulier si elle était largement applicable à une variété de systèmes. Cette amélioration pourrait se traduire par un rendement plus élevé de l'or dissous dans des conditions de dissolution standard, un cycle de temps plus court pour cette étape, les conditions de fonctionnement moins sévères, l'utilisation de petites quantités d'ingrédients lixiviant, ou par d'autres moyens et de réduire les coûts, améliorer la sécurité, ou d'augmenter la récupération d'or. En aucune façon d'ouvrir ou d'améliorer les systèmes de lixiviation généralement utilisés sans l'utilisation de composés métalliques toxiques, ni celui qui est largement applicable.
Le brevet US 3597290 décrit un procédé de dissolution chimique des métaux, et décrit en particulier la gravure de cuivre avec acidifie le peroxyde d'hydrogène. Le procédé utilise une solution contenant un acide fort organique ou un acide minéral (à l'exclusion des hydracides halogénés), plus du peroxyde d'hydrogène et d'un alcool aliphatique inférieur saturé. Ce système peut contenir, facultativement, une quantité catalytique d'un sel d'un métal ayant un potentiel d'oxydation inférieur à celui du métal dissous afin d'améliorer la dissolution de celui-ci, de catalyseurs, y compris des sels de métaux tels que l'argent, le mercure, le palladium, l'or et le platine. En option, le système peut comprendre des composés azotés ayant au moins un site de liaison au cuivre, tel que l'urée, la pyridine, des amines et des amides d'acide. Contrairement à la présente invention, brevet '290 ne fournit pas une méthode pour augmenter la dissolution de l'or ou d'autres métaux, mais propose plutôt d'utiliser des quantités catalytiques de certains sels de métaux nobles afin d'améliorer la dissolution d'autres métaux ayant un potentiel d'oxydation plus élevé tels que le cuivre. Ces composés azotés sont en option plutôt que nécessaire, et sont utiles comme agents de liaison au cuivre pour inhiber le cuivre dans la sous-cotation sélective lors de la gravure.
brevet polonais PL 130,801 révèle un procédé pour extraire l'argent et le cuivre à partir de minerais sulfurés en utilisant un mélange de pyridine et son chlorhydrate pour dissoudre les minéraux contenant ces ions métalliques, la séparation de la matière inerte par filtration, addition d'eau, extraction avec du chloroforme pour éliminer le chlorure d'argent et la pyridine, et la récupération cuivre à partir de la phase aqueuse par électrolyse. Le processus est similaire à de nombreux exemples dans la littérature où les composés hétérocycliques contenant de l'azote utilisé pour les complexes métalliques dans un solvant organique. Le brevet '801 concerne un système de lessivage d'or améliorant la performance contenant un ligand et l'oxydant par addition de quantités catalytiques d'un composé hétérocyclique aromatique contenant un atome d'azote cyclique ou le soufre. Au contraire, elle implique l'utilisation de grandes quantités de pyridine et de chlorhydrate de pyridine pour dissoudre les sulfures d'argent et de minerais de cuivre et des ions cuivre mise en oeuvre de la séparation des ions d'argent par extraction de l'argent et de la pyridine dans une solution de chloroforme.
Le brevet US 5169503 révèle un procédé d'extraction de métaux à partir de minerais à l'aide d'un système de lixiviation contenant un sel de chlorure, un sel d'hypochlorite et de l'acide cyanurique éventuellement, un composé hétérocyclique azoté. l'acide cyanurique est utilisé pour renouveler la solution d'hypochlorite dans des conditions acides, même s'il est établi que la vitesse de réaction entre les métaux étant dissous et les composés contenant du chlore est réduite.
De nombreux exemples dans la littérature décrivent l'utilisation de composés azotés aromatiques hétérocycliques, en combinaison avec des composés d'or solubles pour une variété de fins. Le brevet US n ° 4654145, le brevet japonais n ° 01111824; Z.Zhang et W. Gam, Huaxue Shiji, 137-139 (1982) et M.Igbal et M. Ejaz, Radiochim. Acta, 22, 37-39 (1975). Par exemple, une application commune pour l'extraction de l'or à partir de solutions aqueuses de leurs sels, par extraction au solvant. Ces composés hétérocycliques aromatiques contenant de l'azote et des résines utilisées dans la préparation pour la séparation des espèces métalliques solubles dans la solution et sont souvent utilisés pour améliorer le placage d'or, ce qui permet l'utilisation de densité de courant élevée sans perte d'efficacité de courant. Comme l'a recommandé le plus proche antérieur connu du brevet EP 0358004, C 22 B 11/08, publ. Procédé 14.03.90 d'or de dissolution et un système de lixiviation ligand / oxydant, comprenant l'addition au système d'une quantité catalytique d'un composé catalytique. Dans toutes ces applications, les composés hétérocycliques aromatiques réagissent avec les ions métalliques solubles et ne sont pas impliqués dans la dissolution des métaux, en fait, dans le cas du procédé de placage est juste l'inverse, on enlève le métal de la solution.
Ainsi, un procédé pour améliorer le fonctionnement des systèmes de lixiviation pour la dissolution du métal d'or qui va augmenter la vitesse de dissolution, de permettre une meilleure récupération des métaux, utiliser moins de produits chimiques ou de permettre l'utilisation de conditions moins sévères. En particulier, le besoin d'un procédé catalytique d'amélioration de ces systèmes de lixiviation qui est largement applicable à un grand nombre de systèmes et qui ne nécessite pas l'utilisation de sels de métaux toxiques.
La présente invention fournit une amélioration de la lixiviation du métal de l'or dans les systèmes utilisant un ligand et un oxydant. L'amélioration comprend l'addition de quantités catalytiques de composés aromatiques hétérocycliques éventuellement substitués contenant un atome d'azote cyclique ou le soufre, sous réserve que les hétéroatomes sont le soufre et / ou azote dans le cycle et hétérocycliques des composés hétérocycliques tels disponibles pour la coordination à la surface du métal de l'or non dissous.
Dans les systèmes classiques utilisés pour la lixiviation d'or primaire conversion d'oxydant métallique en or à l'ion d'or et d'un ligand qui forme une liaison de coordination avec l'ion d'or résultant.
Dans le système perfectionné de l'invention est ajouté, contenant de l'azote et / ou de soufre, hétérocycle aromatique qui favorise la dissolution de l'or à des vitesses plus rapides ou dans des conditions plus douces que sans lui. Le complexe d'or obtenu est constitué d'une liaison coordonnée à un ion métallique oxydé avec le ligand supplémentaire et éventuellement des molécules de solvant; composé hétérocyclique aromatique ne fait pas partie de la sphère de coordination et ne sont pas consommés dans le processus.
Fig. La figure 1 montre l'effet de divers composés hétérocycliques de l'invention, la dissolution de l'or dans le chlorure de sodium, - hypochlorite de sodium; Fig. 2 - l'effet de la pyridine à la dissolution de l'or dans le système de bromure de sodium - hypobromite de sodium; Fig. 3 - la dissolution de l'or en cuivre thiosulfate air ammoniacal, en présence ou en l'absence de pyridine; Fig. 4 - or l'efficacité de lixiviation à partir du minerai d'or avec du cyanure de sodium, - l'air en présence ou en l'absence de 5 ppm de N-méthylimidazole.
Tous les systèmes de lixiviation des métaux couramment utilisés à l'heure actuelle, exigent l'addition de ligands de liaison à l'ion métallique et un oxydant pour oxyder le métal. Pour les métaux tels que l'or nécessite des agents oxydants tels que le chlore ou le brome, et de nombreux ligands tels que les ions chlorure ou bromure. De telles solutions de lixiviation sont très corrosifs et doivent être appliqués dans un équipement coûteux qui est inerte vis-à ces substances. et de telles solutions oxydants puissants sont souvent pas sélectifs dans leurs réactions d'oxydation, ce qui conduit à une contamination indésirable du produit métallique désiré.
L'addition de composés activateurs, tels que décrits par les demandeurs invention permet l'utilisation de solutions moins corrosives pour lixiviation des métaux sans perte significative de la vitesse de dissolution du métal. Ceci permet l'utilisation d'un activateur et des quantités minimes de réactifs pour solubiliser les métaux. Non seulement nécessite moins de métal-ligand pour la dissolution à une vitesse acceptable, mais moins réactif pour récupérer et / ou à la décomposition, à la fin du cycle de lixiviation. Dans les applications d'exploitation minière utilisant, par exemple, le cyanure de sodium, l'utilisation de plus petites quantités de cyanure signifie également que l'utilisation de plus petites quantités de réactifs pour détruire le cyanure, à la fin du cycle de lixiviation. En outre, plus la concentration de cyanure dans les déchets de l'eau dans l'étang, solution enceinte et d'autres solutions aqueuses, signifie moins de risque de pollution de l'environnement. Ainsi, la présente invention fournit des avantages importants pour l'industrie minière.
Dans l'invention revendiquée envisage un procédé d'amélioration de la dissolution ou de la lixiviation du métal d'or par addition de quantités catalytiques de certains composés aromatiques hétérocycliques contenant de l'azote et / ou du soufre dans le cycle aromatique dans le système de lessivage ligand / oxydant.
Conformément aux objectifs de la présente description de l'invention revendiquée, on entend que les termes suivants ont les significations indiquées ci-dessous.
Le mot «lessivage» signifie «pour extraire ou dissoudre le composant fait partie d'un mélange solide." La solution de lixiviation est un système ou d'une solution ou d'un système contenant les composants nécessaires pour extraire une composante souhaitée. En particulier, les demandeurs ont utilisé pour décrire la dissolution du système d'agent de lixiviation de l'or contient à la fois un agent oxydant qui oxyde le métal or cation or, et d'un ligand de coordination pour le cation d'or.
En utilisant l'expression "quantité catalytique" ou "composé catalyseur" par rapport à certains composés hétérocycliques. Les candidats font référence au sens traditionnel de «catalyseur», à savoir les composés hétérocycliques ne sont pas modifiés au cours du processus de lessivage. Plus précisément 9 Webster New Collegiate Dictionary (Neuvième New Collegiate Dictionary de Webster) définit le terme "Catalysis", comme "le changement et surtout d'augmenter la réaction chimique induite par un matériau sans modifier chimiquement à la fin de la réaction." Typiquement, le catalyseur est utilisé en quantités inférieures aux quantités stoechiométriques.
À l'aide du "système de lixiviation en utilisant le ligand et l'oxydant." Expression Les candidats comprennent le cyanure et l'air ou de l'oxygène dissous, l'hypochlorite et de chlorure; le bromure et le brome; l'iodure et l'iode; des ions thiocyanate et ferriques; thiourée et ferriques ions; le thiosulfate d'ammonium, du cuivre, de l'ammoniac et de l'air ou de l'oxygène dissous; l'oxygène et l'air malononitrile ou dissous; et le cyanure, le chlorure, le bromure, l'iodure, le thiocyanate, le thiosulfate, le malononitrile, et de la thiourée sur une électrode d'or à la dissolution anodique de l'or.
"Lors de la description d'azote et de soufre hétérocycliques, des composés aromatiques" de l'invention. Les demandeurs comprennent les composés dans lesquels au moins un atome d'azote et / ou soufre dans le cycle est disponible pour la coordination à la surface du métal solide au cours du processus de dissolution. Plus précisément inclus sont des hétérocycles aromatiques contenant de l'azote et / ou soufre dans le cycle, dans lequel
1) L'atome d'azote dans le cycle est non protoné;
2) au moins un atome de soufre ou un atome d'azote dans le noyau n'a pas de substituant;
3) l'encombrement stérique ne prévient pas l'hétéroatome et la structure aromatique contenant de coordination avec la surface de connexion du métal solide non dissous. L'encombrement stérique peut être due, par exemple, la présence de grands substituants sur le cycle qui empêchent l'approche de l'une ou l'autre ou l'hétéroatome du noyau hétérocyclique à la surface métallique.
les composés hétérocycliques de l'invention
les composés hétérocycliques de l'invention sont efficaces dans une grande variété de systèmes lixiviant typiques pour les procédés d'extraction d'or, en particulier dans les systèmes de cyanure de sodium, - l'air; chlorure de sodium, - l'hypochlorite; du bromure de sodium - bromo; cuivre - thiosulfate d'ammonium; thiocyanate ferrique ion; la thiourée et des ions ferriques; iodure et du malononitrile. Cependant, comme décrit ci-dessous, tous les additifs proposés peut être tout aussi efficace avec tous les systèmes de lixiviation en raison de la possibilité de réactions secondaires ou des propriétés chimiques de chacune des solutions de lixiviation particulières (pH, le potentiel de la solution, le ligand, l'or, etc.). et les demandeurs suggèrent que les composés aromatiques hétérocycliques de la présente invention agissent non seulement comme activateurs dans une variété de systèmes lixiviant typiquement utilisés pour les opérations d'extraction de l'or, mais seront applicables à d'autres opérations nécessitant la dissolution de l'or.
Les composés aromatiques hétérocycliques de la présente invention ont plusieurs propriétés en commun. Ils contiennent tous un ou plusieurs atomes et / ou de soufre, d'azote dans le noyau aromatique hétérocyclique, dans lequel l'atome d'azote ou de soufre hétéroatome est disponible pour la coordination à la surface du métal. L'hétéroatome doit avoir une paire d'électrons libres pour la liaison de coordination. les composés contenant de l'azote ne doivent pas être empêchés stériquement, et le pH de la solution de lixiviation doit être alcaline suffisamment pour que les hétéroatomes d'azote ne sont pas soumis à une protonation. Des exemples de composés aromatiques hétérocycliques portant de l'azote appropriés comprennent la pyridine, l'imidazole, le N-méthylimidazole, le 2,2'-dipyridyle, 2,3-, 2,4-, 3,5- et 2,6-lutidine, la collidine, la pyrazine, les triazines substituées, pyrimidines, et des dérivés cycliques condensés, tels que quinoléine, isoquinoléine, benzimidazole et benzimidazoles substitués tels que le 2-aminobezimidazol. Des exemples de composés inefficaces ou moins efficaces dans lesquels l'azote a un empêchement stérique, sont le 2,6-diphénylpyridine, le 2,6-t-butylpyridine et de la pyridine-N-oxyde.
De même, l'hétéroatome de coordination, il ne doit pas être protoné; dans le cas des composés hétérocycliques contenant de l' azote, le pH du système lixiviant doit être supérieur à pKa du composé contenant de l' azote protoné. Des composés contenant du soufre de l'invention et ne doivent pas être entravés stériquement. Des exemples de composés contenant du soufre appropriés sont le thiophène, l'acide 3-thiophènecarboxylique et de 3-thiopheneacetonitrile. dérivés Inefficacité ou moins efficaces thiophène comprennent tetrabromtiofen et 3, 6, 9, 14 - tetratiabitsiklo [9.2.1] tétradéca - 11, 13 - diène. Inactivité de composés ne signifie pas nécessairement l'absence de liaison à la surface métallique.
Par composés aromatiques hétérocycliques candidats signifient composés entrant dans la définition traditionnelle du "aromatique" est largement utilisé dans la chimie organique (J.Marh, Advanced Organic Chemistry, 4ème Ed. Wiley & Sons, 1992). Ces composés organiques cycliques contenant au moins un hétéroatome (ou un atome autre que le carbone), dans laquelle l'anneau est fermé ou est un système entièrement conjugué condensé avec 4n + 2 (n = 0,1,2,3 y .. ). électrons pi dans le système conjugué. Par exemple, la pyridine, un cycle à 6 chaînons avec l'atome d'azote est un composé hétérocyclique aromatique tel dans lequel l'atome d'azote et un atome de carbone dans chaque cycle est donnée dans un système d'électrons pi-pi six électrons communs. Thiophène, un cycle à 5 chaînons avec un atome de soufre, et est aromatique, avec le soufre donneur de deux électrons et chacun des atomes de carbone, un don d'électrons pour un total de six électrons pi. un caractère aromatique et inclut d'autres caractéristiques importantes des molécules utiles dans cette invention. Des anneaux décrits ci-dessus ont une structure plate ou plane, avec l'atome hétérocyclique comme faisant partie du squelette moléculaire plan. Cependant, le cas échéant, la molécule du composé actif soit plane. Les substituants peuvent considérablement affecter l'activité des composés hétérocycliques en modifiant l'aromaticité de l'anneau. Comme 2-hydroxypyridine et 4-hydroxypyridine sont inefficaces comme catalyseurs pour la cyanuration de l'or, alors que 3-hydroxypyridine est un catalyseur efficace. L'inertie est une conséquence du fait que les dérivés de 2- et 4-hydroxy sont présents sous forme ketotautomerov qui affaiblit ainsi le caractère aromatique et protoner l'atome d'azote de la pyridine. Cette tautomère n'a pas d'importance pour la 3-hydroxypyridine, qui reste totalement aromatique avec un atome d'azote non protonée. Des exemples similaires sont possibles pour d'autres systèmes cycliques aromatiques contenant de l'azote.
Divers substituants sur les noyaux hétérocycliques aromatiques peut être tolérée ou même augmenter l'activité des composés aromatiques hétérocycliques mère. Par les composés de départ comprennent, par exemple, la pyridine, la pyrazine, la pyrimidine, l'imidazole, l'oxazole, le pyrazole, le thiazole, le thiadiazole, le thiatriazolyle, thiazine, thiophène et triazole et les dérivés hétérocycliques condensés tels que la quinoléine, l'isoquinoléine, le benzimidazole, benzothiophène. Les substituants comprennent les groupes alkyle (tel que méthyle, éthyle, propyle et butyle), des groupes alcoxy (par exemple méthoxy et éthoxy), des groupes aryle (tels que phényle et Toll), des groupes hétérocycliques aromatiques (tels que les groupes pyridyle, pyrazolyle, imidazolyle et thiophényle ), amino et des groupes amino substitués (tels que la 4-diméthylaminopyridine) un groupe carboxy, un acétyle, et l'halogénure (fluorure, chlorure, bromure, iodure). Une combinaison de substituants et efficacement; par exemple, des substituants amino et hydroxyle sur une chaîne alkyle en tant que substituant de la pyridine (tel que le 2- (2-hydroxyéthyl) pyridine) conduisent à des composés actifs. des composés aromatiques hétérocycliques avec des substituants qui augmentent le pK un atome d'azote dans le cycle sont des activateurs plus efficaces contenant de l' azote, permet le système lixiviant fonctionne dans la gamme appropriée de pH.
Les composés peuvent être testés pour leur effet d'activateur par voie électrochimique. A titre de comparaison, les solutions du ligand d'intérêt avec ou sans l'activateur, le voltammogramme cyclique. Dans ce procédé, le changement de tension entre les deux électrodes (une électrode de travail en or et une contre-électrode, tels que le platine), en mesurant le flux de courant entre les électrodes. Si la tension de l'électrode est à une oxydation ou une réduction réaction spécifique, un courant circule entre les électrodes. il y a un courant d'augmentation à une tension donnée à la dissolution de l'électrode en or. Ce courant électrique est appelé vague d'oxydation ou comme un potentiel anodique de crête à laquelle cela se produit est le potentiel d'oxydation. Sans un activateur, ou avec une vague d'oxydation du composé inefficace est observée uniquement à un ligand défini par le potentiel d'oxydation sont en solution. En présence d'un activateur dans la région passive du voltammogramme la version inactivée il d'onde supplémentaire. Cette nouvelle vague est cathodiquement décalée (à un potentiel inférieur) du pic dans le cas inactivée.
Par exemple, dans une solution de chlorure, le procédé produisant le pic anodique est la suivante:
Au + 4Cl - ---> [AuCl 4]- trois de l'électron,
Ce procédé correspond à la dissolution anodique de l'or. En présence de faibles concentrations même d'activateur observé pic cathodique supplémentaire au premier pic, mais le même composé obtenu à l'or. Autrement dit, le composé activateur est activé par l'électrode en or pour la dissolution.
Il est important que les nouveaux résultats d'ondes d'oxydation de la combinaison du ligand (par exemple l'ion chlorure) avec l'activateur (comme la pyridine), d'une manière synergique, ce qui déplace effectivement la vague d'oxydation de l'or à un potentiel plus faible. Des effets similaires sur les potentiels d'oxydation en or à voir avec différentes combinaisons d'activateur (tel que la pyridine, l'imidazole, le N-méthylimidazole ou l'acide 3-tiolfenkarbonovaya) et le ligand (tel que le chlorure, le bromure, l'iodure, thiocyanate, le malonitrile ou le cyanure). Dans certains cas, comme avec le thiosulfate en tant que ligand, un nouveau pic est pas observé, au lieu du courant due à l'oxydation de l'or augmente considérablement lors de l'addition de faibles concentrations d'un activateur tel que la pyridine. Le courant accru indique une augmentation de la dissolution anodique de l'or dans une solution de thiosulfate.
Ce nouveau ou amélioré pic est pas observé dans les solutions de l'activateur avec un anion qui ne se coordonne pas à l'or (tel que le perchlorate ou le nitrate); Ainsi, un nouveau pic est pas le seul résultat de l'interaction de l'activateur avec la surface d'or.
voltammogrammes cycliques d'une électrode en or dans les solutions de l'activateur varie considérablement. En effet, la plupart des composés hétérocycliques azotés dans des conditions non acides, il n'y a aucune preuve de la dissolution de l'électrode en or.
L'expérience antérieure n'a aucune preuve de cette capacité à déplacer les activateurs d'onde d'oxydation à un potentiel inférieur. En effet, lorsque la pyridine est utilisée dans des solutions contenant des anions tels que le perchlorate, qui ne forme pas un complexe d'or stable, il a été constaté que la pyridine améliore le potentiel de vague d'oxydation et par conséquent protéger la surface d'or par des réactions anodiques (p Zelenay, LM Rice Jackson et A. Wieckowski, Langmuir, 6, 974-979 (1990)).
Comme il n'y a pas de liste complète des azote et de soufre hétérocycliques aromatiques possibles de cette invention, la liste suivante contient les composés les plus appréciés: 2- (aminométhyl) pyridine, 2-aminopyridine, 3-aminopyridine, 4-aminopyridine, le 2,2-dipyridyle 2-propylpyridine, le 2,2-pyridyle, la pyridine, le 3-aminopyrazole, le 3,5-diméthylpyrazole, le 4,4-dipyridyle, le 2,2'-dipiridilamin, le di-2-pyridylcétone 4-t-butylpyridine, 2-chloropyridine, la 2,4,6-collidine, la 4-diméthylaminopyridine, la 2-éthylpyridine, la 2-fluoropyridine, la 2- (2-hydroxyéthyl) pyridine, la 3-hydroxypyridine, le 2,3-lutidine, la 2,4-lutidine, la 2 , 6-lutidine, 3,5-lutidine, 2-méthoxypyridine nicotinamide acide 2-phénylpyridine nicotinique, la 3-phénylpyridine, 4-phénylpyridine, la 2-picoline, 3-picoline, 4-picoline, la 2-thiophènecarboxylique, 3 acide -tiofenkarbonovaya, le 4-méthylpyrazole, le 3-méthylpyrazole, 1-phénylpyrazole, le pyrazole, le 1- (3-aminopropyl) imidazole, le 2,2-bis (4,5-diméthylimidazole), le 4,5-1,2 ditsianoimidazol -dimetilimidazol, le 2-éthylimidazole, l'histamine, l'ester éthylique de l'histidine, l'imidazole, le N-méthylimidazole, le 2-metilimidazod, le 4-méthylimidazole, le N-2-phénylimidazole acétylthiophène 3-bromothiophène 2,5-dimethylthiophen, le 2-méthylthiophène, 3 -metiltiofen, le thiophène, l'acide 3-thiophène, la quinoléine, le 2-aminobenzimidazole,
2-thiophèneméthanol 2-aminothiazole 3-amino-5,6-diméthyl-1,2,4-triazine, le 2-amino-1,3,4-thiadiazole, 2,4,5-trimetiloksazol, trimetilpirazin, le benzimidazole, le benzothiazole, le benzotriazole, l'isoquinoléine, la phénanthroline-1,10, le 2-aminoimidazole, aminopyrazine, 2-aminopyrimidine, la 2-amino-4,6-diméthylpyrimidine, la 2,6-diamino pyridine, la L-histidine, la DL-histidine, la pyrazine tétraméthylpyrazine, trimetilpirazin.
ligand SYSTEM / oxydant
Système d'infiltration selon l'invention - sont généralement des systèmes connus dans l'art, qui sont efficaces dans la dissolution de l'or à l'aide d'un système ligand / oxydant, et en particulier impliquant des ions cyanure et de l'air ou de l'oxygène dissous; ion chlorure avec l'hypochlorite de sodium (un agent stabilisant peut être utilisé tel que l'acide sulfamique); l'ion bromure avec du brome, en présence d'un stabilisant tel que l'acide sulfamique; l'iodure et l'iode; des ions thiocyanate et ferriques; thiourée et ferriques ions; l'anion thiosulfate avec l'ion cuivre comme catalyseur en présence d'ammoniac et d'air ou d'oxygène dissous; malononitrile et de l'air ou de l'oxygène dissous et de cyanure, un chlorure, un bromure, un iodure, un thiocyanate, un thiosulfate, le malononitrile ou thiourée et une électrode d'or à un potentiel approprié pour chacun de ces ions. Chacun des activateurs mentionnés ci-dessus peuvent ne pas convenir à toutes les solutions de lixiviation en raison de réactions secondaires, le pH, ou à une mauvaise fixation à la surface de l'or dans les conditions de réaction dans le système particulier.
Le choix de la concentration de ligand, de la concentration d'oxydant, la concentration de l'activateur et du pH dépendent du système utilisé pour l'extraction. Des combinaisons appropriées de l'activateur de l'agent d'extraction peuvent être criblés par voie électrochimique, tel que décrit ci-après.
Cyanures avec de l'air ou de l'oxygène dissous est le système de lessivage avantageux, le plus largement utilisé pour l'extraction d'or (par exemple, l'extraction de l'or et de l'extraction de l'or dans la galvanoplastie). EBSaubestre dans "Modern Electroplating", EA Lôwenheim, Ed., John Wiley and Sons, Inc., New York, 1953, p. 748-770. De tels systèmes fonctionnent généralement à pH alcalin , du fait de la formation de HCN, ce qui réduit le pH est inférieur à 10 (pKa 9,1 HCN). Le choix de la concentration de cyanure et de l'activateur dépend de l'application particulière, la mesure des vitesses de dissolution d'or avec de la poudre d'or, des feuilles, des tiges ou des disques de l'air qui donne les meilleurs résultats, les concentrations de cyanure faibles (2-10 cyanures mM). Cependant, les études montrent que l'activation électrochimique de dissolution de l'or peut être observée sur une large gamme de concentration en cyanure. Lorsqu'ils sont utilisés dans les mines d'or choix de la concentration en cyanure dans l'industrie dépend de nombreux facteurs. De préférence, une faible concentration d'activateur (1-10 ppm), à des concentrations standard de cyanure. Des activateurs appropriés pour des valeurs alcalines du pH, pour la réaction de cyanuration conventionnelle. Dans certains cas, la cyanuration est réalisée à un pH faible (<9). Activator dans ces conditions doit être choisi de manière à ne pas protoné hétéroatome dans le noyau hétérocyclique. Pour le cyanure systèmes intègrent une large gamme d'activateurs.
Les composés préférés sont l'imidazole, le N-méthylimidazole, le 1,2-diméthylimidazole, la pyridine, alpha-, bêta-, gamma-picoline, 2-, 3-, 4-aminopyridine, la 4-diméthylaminopyridine, le thiophène, l'acide 3-thiophènecarboxylique, l'acide 3- l'acide, la pyrazine, la 2,4,6-trimetiltriazin, le thiazole, la L-histidine, la 2-aminopyrimidine, la nicotinamide, le 2-amino-4,6-diméthyl- thiophène. Les plus préférés sont l'imidazole, le N-méthylimidazole, la L-histidine et de 2-aminopyrimidine.
Le système chlorure d'hypochlorite peut être utilisé comme une alternative au cyanure. Voir, par exemple, JB Hiske et VP Atluri, traitement des minerais et métallurgie Extracive Review, 4,95 à 134 (1998) et le brevet US 5,169,503, incorporés ici par référence. Ce système est habituellement exécuté à plus de 3% de NaCl et à un pH de 5 à 8. L'utilisation d'activateurs permet que ce système fonctionne dans une des conditions moins corrosives avec moins de chlorure. Le système d'agent de lixiviation de chlorure préféré est constitué par les activateurs de 2-5% de NaCl (ou une autre source de chlore) avec de l'hypochlorite de sodium à 0,1% avec un pH de 8-8,5. Dans les deux cas, un stabilisant pour l'hypochlorite. Stabilisateurs sont des composés dans lesquels le chlore est encore actif, mais est sous une forme plus stable. Le stabilisant doit être choisi de telle sorte qu'il n'a pas participé à la réaction de dissolution de l'or. Des stabilisants appropriés pour la solution de lixiviation de chlorure de sodium - hypochlorite de sodium est l'acide sulfamique. Dans ce cas, l'acide sulfamique réagit avec l'anion hypochlorite pour générer des acides N-chlorosulfamic dans lequel le chlore est toujours actif. Voir, par exemple, "Kirk-Othmer Encyclopedia of Chemical Technology", v. 21, John Wiley and Sons, New York, 1983, p.949-956.
L'activateur doit être choisi de telle sorte que l'hétéro-atome du composé aromatique hétérocyclique est disponible pour la coordination à la surface d'or et il n'y a pas d'interaction avec les autres composants de la solution de lixiviation. Les activateurs préférés sont la pyridine, alpha-, bêta-, gamma-picoline, la di-2-pyridylcétone, le 2,2-dipyridyle, le 3,5-lutidine, la 2,6-lutidine, la 2,3-lutidine et le N-méthylimidazole.
Système bromure de brome peut être utilisé comme une alternative au cyanure. Voir, par exemple, JBHiskey et VP Atluri, traitement des minéraux et de la métallurgie extractive Review, 4,95-134 (1988); J.Marsden et I.House, "The Chemistry of Extraction d'or", Ellis Horwood, New York, 1992, pp.304-305; et A. Dadger, Journal of Minéraux, métaux et matériaux Society, 41, 37-41 (1989), qui sont incorporés par référence. Arguments pour le choix de l'activateur sont les mêmes que pour le chlorure de système - hypochlorite. Le système de bromure préféré comprenant un activateur, composé de 1% de NaBr (ou autre source d'ion bromure), 0,3% de brome en présence d'acide sulfamique, de pH 9,0. Les activateurs préférés sont la pyridine, alpha-, bêta-, gamma-picoline, la di-2-pyridylcétone, le 2,2-dipyridyle et la 3,5-lutidine, la 2,6-lutidine, la 2,3-lutidine, la 2,3-lutidine et le N-méthylimidazole.
Thiosulfate-cuivre-ammoniac-air ou de l'oxygène dissous peuvent être utilisés comme une alternative au cyanure. Voir, par exemple, JB Hiskey et VP Atluri, traitement des minerais et métallurgie extractive Review, 4,95-134 (1988); J. Marsden et I.House, "The Chemistry of Extraction d'or", Ellis Horwood, New York, 1992, pp. 303-304; C.Changlin, H.Jiexue et G.Qian, "Lixiviation Gold par Low Concentration Nhisulfate Solution", Gold Forum Randol, Vancoucer '92, Mars 25027, 1992, pp. 293-298, J.Tao, C.Jin et X.Shi dans «hydrométallurgie», JB Hiske et GWWarren, Eds., Society for Mining, Metallurgy and Exploration, Jnc. , Littleton, CO, 1993, pp. 119-126; et MJ Nicol, CA Fleming et RL Paul dans «La métallurgie extractive de l'or en Afrique du Sud", Volume 2, GG Stanley, Ed., Institution sud-africaine des mines de la métallurgie, Johannesburg, 1987, 831-905, qui sont incorporés ici par références. gamme de concentrations de réactifs peuvent être utilisés dans des systèmes thiosulfates: ion thiosulfate - 0.1 - 0,25 M; des ions cuivre (II), - 0,01-0,15 M; l'ion ammonium (comme le thiosulfate, l'hydroxyde et sulfate), - de 0,5 à 4,8 M. Les conditions préférées sont 0,1 M de thiosulfate de sodium, 0,01 M de sulfate de cuivre et 0,5 M d'hydroxyde d'ammonium. Les activateurs préférés sont la pyridine, alpha-, bêta-, gamma-picoline, la di-2-pyridylcétone, le 2,2-dipyridyle, le 3,5-lutidine, la 2,6-lutidine, la 2,3-lutidine, l'imidazole, le N- méthylimidazole, le thiophène, l'acide 3-thiophènecarboxylique, l'acide 3-thiophène, pyrazine, 2,4,6-trimetiltriazin et thiazole.
D'autres lixiviants d'or peuvent être utilisés dans le même, à savoir le système, dans des conditions normales utilisées pour ce système d'agent de lixiviation, il est ajouté à l'activateur. Système iodure d'iode est utilisé en tant que la lixiviation de l'or. Pour utiliser une large gamme de concentrations dans une large gamme de pH. Toutefois, un taux de dissolution d'or acceptable donne 0,03 M d'iodure de sodium en présence de 0,005 M d'iode à un pH de 5. (PHQiand, JB Hiske «hydrométallurgie», 27, 47-66 (1991) et FW Devries et JBHiskey, "Impact environnemental de lixiviants: Un aperçu qui englobe cyanuré Chemistry ", Forum Randol Or, Vancouver'92, Mars 25-27, 1992, p.89-92). Le thiocyanate de pseudohalogénure et utilisé comme agent de lixiviation de l'or. J. Marsden et I.House, "The Chemistry of Extraction d'or", Ellis Horwood, New York, 1992, p.303-304; et O.Barbosa et AJMonhemius dans "Precious Metals'89", MC Jha et SDHill, Eds., Les minéraux, les métaux amd Materials Society, p. 307-339 (1988)). Une réactivité avec ce ligand contiennent typiquement 10 à 15 g de thiocyanate / L de sodium et de 1 à 10 g / l de l'ion ferrique comme oxydant dans la gamme de pH de 2-3. Malononitrile - un autre pseudo- qui est utilisé comme agent de lixiviation de l'or en présence d'air ou d'oxygène. (HJHeinen, JAEisele et BJScheiner, "Malononitrile Extraction de l'or De Minerais", Bureau of Mines Rapport d'enquête, 7464, 1970 et
KRSandgren et JE Murphy dans «hydrométallurgie», JB Hiskey et GW Warren, Eds., Société pour l'exploitation minière, de la métallurgie et Exploration, Inc., Littleton, CO, 1993, p. 301-310). Les réactions avec ce ligand utilisent typiquement 0,01-1,0% malononitrile sur une large gamme de pH (7,5-12). Thiourée - Un autre composé qui est utilisé comme agent de lixiviation de l'or, avec l'ion ferrique ou le peroxyde d'hydrogène comme oxydant (J. Marsden et I.House, "The Chemistry of Extraction d'or", Ellis Horwood, New York, 1992, p.299- 302; MJNicol, CAFleming et RL Paul dans «La métallurgie extractive de l'or en Afrique du Sud", V. 2, GGStanley, Ed, Institution sud-africaine des mines de la métallurgie, Johannesburg, 1987, p.845-846 ;. JBHiskey et VPAtluri. traitement des minéraux et de la métallurgie extractive Review, 4,95-134 (1988). Les réactions avec ce ligand généralement utilisé thiourée (1-5 g / l) et de l'ion ferrique (0,5-5 g / l) à pH 1- 3.
des composés hétérocycliques aromatiques de l'invention et les réactifs utilisés dans les systèmes de ligand / oxydant lixiviation décrits sont bien connus dans la technique et vendu. L'invention est illustrée par les exemples non limitatifs suivants.
Exemple 1.
Activation de la dissolution d'or dans une solution de chlorure de sodium - hypochlorite à un pH de 8,5
On montre qu'à cette valeur de pH élevée d'hypochlorite de sodium par lui-même est un agent oxydant faible pour provoquer une dissolution significative quelconque de l'or. Cependant, en présence de l'activateur, cet agent oxydant faible est très efficace.
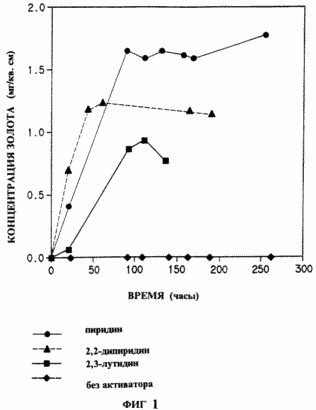 |
Dans cet exemple, l'addition de composés activateurs permet l'utilisation d'hypochlorite comme oxydant dans des conditions dans lesquelles d'autres cas, la dissolution de l'or peu ou pas du tout. Les réactions ont été effectuées dans une solution tampon à pH 8,5, préparé comme suit. Le borate de sodium (0,955 g) et de l'acide sulfamique (0,05 g) a été mélangé avec environ 40 ml d'eau, pureté par HPLC (pour chromatographie en phase liquide à haute performance pure). Le mélange est agité jusqu'à dissolution complète. Du chlorure de sodium (1,25 g). Le pH a été ajusté à 8,5 avec HCl 1N. l'hypochlorite de sodium normalisé a été ajouté à une solution à 0,1% en poids et le pH est à nouveau ajusté à 8,5. La solution a ensuite été transférée dans une fiole jaugée de 50. A la solution, on a ajouté l'activateur. Solution aqueuse a été ajusté le volume de pureté HPLC. Une aliquote de 2 ml ont été prélevés au temps 0. La solution restante a été versée dans un récipient avec un morceau prémesurée d'une feuille d'or (1 cm x 5 cm x 0,1 mm) et des aliquotes ont été enlevés périodiquement pour l'analyse de la teneur en or. Les échantillons ont été analysés par la conversion du complexe d'or dissous [AUBR 4]- l' extraction du bromure dans l' oxyde de chloroforme trioctylphosphine et en mesurant l'absorbance de cette solution pour déterminer la concentration d'or (FFBeamish ahd JC Van Loon, « Les progrès récents dans la chimie analytique des métaux nobles", Pergamon Press, New York, 1972, p.322-323 et WNNolbrook et E. Rein, Analytical Chemistry, 36, 2451 à 2.453 (1964). Les taux de dissolution de l'or ont été calculées debout tracé or dissous (microgrammes d'or par sq. cm. ... de papier) en fonction du temps en heures Nombre d'heures a été enregistré à l'endroit où la concentration de l'or a atteint un maximum dans le tableau 1 ci-dessous répertorie l'activateur utilisé et les résultats obtenus: |
Fig. La figure 1 montre graphiquement les mesures typiques de concentration en or dissous en fonction du temps pour plusieurs réactions.
Exemple 2. L'activation de la dissolution de l'or dans le bromure de brome sodium pyridine.
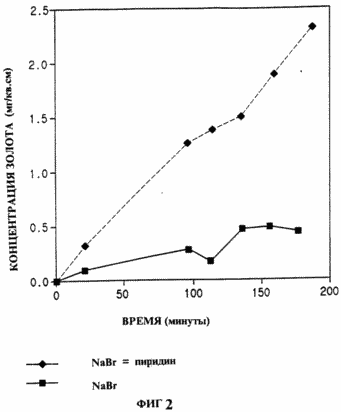 |
Dans cet exemple, l'activateur catalyse la dissolution de l'or dans une solution contenant le bromure de sodium et un agent oxydant préparé par addition de brome à une solution de base; formant ainsi gipobromid (RCTroy et DW Margerum, Inorganic Chemistry, 30, 3538 à 3543 (1991). bromure de sodium (1,00 g), du borate de sodium (1,910 g) et de l'acide sulfamique (0,10 g) a été mélangé avec 90 ml pureté HPLC eau. solution de NaOH pH a été ajusté à 9,0. le mélange a été agité dans de la glace 0,25 h. 100 pi de brome. On agite le mélange à la température de la glace pendant 0,5 heure, puis réchauffé à la température ambiante. le pH a été ajusté à 9 NaOH, 0, la solution a été transférée dans un ballon de 100 ml jaugée et on ajuste le volume est ensuite divisé en deux solution partielle :. 50 ml a été agité avec un échantillon d'une feuille d'or ayant les mêmes dimensions que dans l'exemple 1, les 50 ml ont été mélangés avec 100 ul de pyridine et on agite avec double échantillon de feuille d'or. A intervalles réguliers, des aliquotes ont été prélevés et analysés comme dans l'exemple 1. Les résultats sont représentés graphiquement sur la Fig. 2. L'échantillon avec de la pyridine montre clairement une vitesse beaucoup plus rapide de dissolution d'or que l'échantillon sans la pyridine. |
Exemple 3.
L'activation de l'or Dissolution dans la solution de cyanure de sodium hétérocyclique azoté
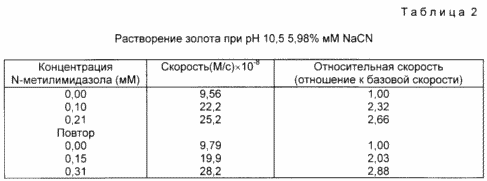
Dans cet exemple, l'addition d'un activateur permet vitesses de dissolution de l'or a augmenté dans un système de cyanure de sodium, - l'air. La réaction est effectuée dans des solutions à pH 10,5 NaCN, préparé de la manière suivante. NaCN (0,033 g) a été ajouté à 100 ml d'eau et 10 ml de tampon phosphate 0,10 M de potassium à un pH de 11. La solution finale de pH a été ajusté à 10,5 par ajout de K 2 HPO 4. La concentration du cyanure a été déterminé pour assurer qu'il a atteint 5,98 mM par titrage avec du nitrate d'argent. Un échantillon d'or (surface de 0,495 sq. Cm) a été obtenu par dépôt sous vide de la couche d'or de 2000 A sur un substrat en matière plastique. Une solution de cyanure de sodium (2,50 ml) a été ajoutée à un échantillon d'or et une ébauche UV a été effectuée à 0 instrument contre la solution de départ. La solution est agitée à 25 ° C et l'absorbance (à 240 nm) a été formé [UA (CN 2]-. Chaque 5 sec pour 200 avec le taux d'ordre zéro constant ont été préparés en effectuant la meilleure ligne droite à travers les points de données A 200 a été ajouté 20 l de 0,013. M solution de N-méthylimidazole préalablement préparée en ajoutant 0,10 g de 7 N-méthylimidazole à 100 ml d'eau la formation de [au (CH) 2]-. 400 encore observé et la constante de vitesse d'ordre zéro déterminé que le taux précédemment par rapport décrit la dissolution de l' or. en présence de l'activateur a été obtenu en divisant le débit constant avec l'activateur de vitesse sans activateur d'ordre zéro. les résultats, y compris la ré-essai, sont indiqués dans le tableau. 2.
Exemple 4.
Activation de l'or Dissolution en Cyanure de sodium Solution hétérocycliques contenant du soufre
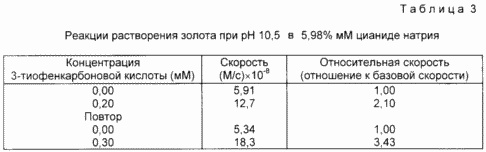
Dans cet exemple, l'addition d'un activateur permet d'augmenter la vitesse de dissolution de l'or dans une solution de cyanure. Les réactions ont été effectuées dans des solutions tamponnées à un pH de NaCN 10,5 préparé comme suit. NaCN (0,027 g) a été ajouté à 100 ml d'eau et 10,0 ml de tampon 0,10 M phosphate à pH 11. Le pH a été ajusté à 10,5 par ajout de K 2 HPO 4. concentration en cyanure a été déterminée (il doit être 4,74 mM) par titrage avec du nitrate d'argent. Un échantillon d'or (surface de 0,495 cm²) a été préparé comme dans l'exemple 3. La solution de cyanure de sodium (2,00 ml) a été ajouté à l'échantillon d'or et une surveillance du rayonnement UV de cette solution. La solution est agitée et maintenue à 25 ° C pendant la réaction de dissolution. Absorbance à 240 nm due à la formation [Au (CN) 2]- lors de la réaction a été mesurée toutes les 5 secondes pendant 100 secondes pour donner un taux d'ordre zéro constant, plus performant en ligne droite à travers les points de données. une solution 9,67 mM d'acide 3-thiophènecarboxylique a été préparée en ajoutant 0,031 g à 25 ml d'une solution contenant 60 h. (V) de l'eau et 40 heures. Le méthanol. Ensuite, l'échantillon d'or dans une solution de cyanure tampon comme décrit ci-dessus, on a ajouté 64 ul d'une solution d'acide 3-thiocarboxylique. La formation de [Au (CN) 2]- suivi avec un autre 100 et déterminé taux constant comme décrit précédemment d'ordre zéro. La vitesse relative de dissolution de l'or en présence de l'activateur a été obtenu en divisant la constante de vitesse pour détecter la présence de l'activateur, sans la vitesse d'activateur de l'ordre zéro. Les résultats, y compris les re-tests sont présentés dans le tableau. 3.
Exemple 5. L'activation de la dissolution de l'or dans le thiosulfate de sodium solution pyridine.
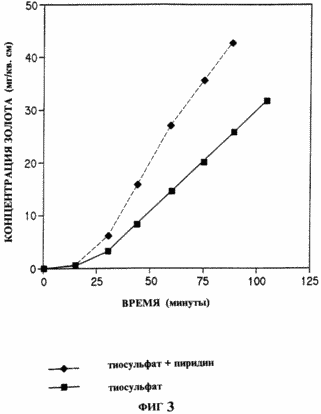 |
Dans cet exemple, l'addition d'un activateur, catalyse la dissolution d'une feuille d'or dans une solution de thiosulfate alcalin avec l'ion cuivre, ajouté en tant que catalyseur d'oxydation. une solution de thiosulfate a été préparée en dissolvant le thiosulfate de sodium (1,242 g de Na 2 S 2 O 3 · 5 H 2 O) et de sulfate de cuivre (0,079 g) dans environ 40 ml d'eau, pureté par HPLC. On a ajouté de l' hydroxyde d'ammonium (5 ml de NH4OH concentré). Le volume de solution dans la fiole a été ajustée à 50 ml pour donner une thiosulfate de sodium 0,1 M, 0,01 M de sulfate de cuivre et 0,5 M d'hydroxyde d'ammonium. A l'instant 0, la concentration d'or, 0,5 ml de sélection, en ajoutant 1,0 ml d'eau régale dans une fiole jaugée de 10 ml et amener au volume. la concentration de l'or a été déterminée par spectroscopie d'absorption atomique dans un four en graphite. La solution restante a été transférée dans le récipient avec bouchon à vis. A été ajouté un morceau de feuille d'or (1 cm x 5 cm x 0,1 mm), le navire a été fermé. Des aliquotes (0,5 ml) ont été recueillies toutes les 15 minutes pour l'analyse de l'or, comme décrit ci-dessus. Fig. La figure 3 montre les concentrations d'or dans cette étude. La procédure ci-dessus a été répétée avec un activateur de la pyridine. Après le transfert de la solution de cuivre ammoniacale thiosulfate dans un récipient avec un bouchon à vis, on a ajouté 1 litre de pyridine, et ensuite un morceau de papier. Des analyses d'or ont été réalisées comme décrit ci-dessus. La comparaison des deux courbes de temps de la Fig. La figure 3 montre que l'échantillon avec de la pyridine donne une vitesse de dissolution beaucoup plus élevée que sans l'activateur. |
Exemple 6. Activation de l'or Dissolution en minerai d'or oxydée en utilisant Sodium Solution Cyanide avec de l'azote Hétérocycle.
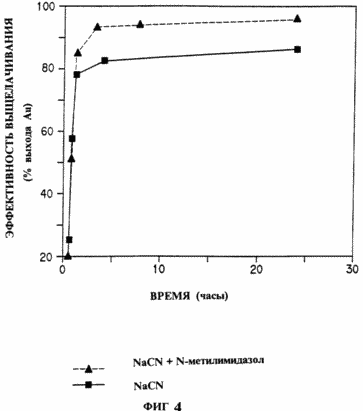 |
Cette expérience a été réalisée avec un minerai d'or qui a été écrasé et broyé à un degré tel que 80% passe à travers un tamis 200. Le minerai est mélangé avec de l'eau pour former une suspension épaisse de 40 à 50% de concentration en matière sèche. Le cyanure de sodium pour donner une concentration finale de la solution de 0,4 g de NaCN / litre. la concentration de l'or a été déterminée par spectroscopie d'absorption atomique. Fig. La figure 4 montre décours temporels pour la solution de lixiviation à partir du minerai agité, tel que décrit ci-dessus et la solution décrite ci-dessus avec 5 mg / l de N-méthylimidazole ajouté. Fig. La figure 4 montre que le N-méthylimidazole catalyse la dissolution de l'or dans les solutions de cyanure. La réaction catalysée atteint une efficacité maximale de la lixiviation de l'or est nettement plus rapide que la réaction non catalysée. |
Exemple 7. Effet de l'azote Hétérocycle activateurs sur l'or Electrodes avec une variété de ligands.
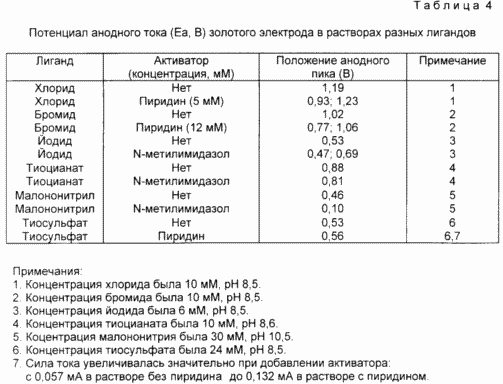
Cet exemple démontre l'effet de l'activateur de la pyridine et du N-méthylimidazole sur le voltamogramme cyclique d'une électrode en or dans une solution de ligand. Tous les potentiels sont liés à une électrode de chlorure d'argent-argent référence. Ligands - chlorure, bromure, iodure, thiocyanate, thiosulfate et malononitrile. électrodes en or pour chaque solution de ligand ont été préparées par électrodéposition d'une couche d'or sur une électrode de carbone vitreux à partir d'une solution de chlorure d'or dans la pureté HPLC de l'eau d'abord effectuer l'oxydation de l'électrode à 1,00 V jusqu'à ce qu'un courant de 0,01 mA ou moins, puis le placage d'or à partir d'une solution non agitée de [ au Cl 4]- dans l' azote à 0,00 et 5,10 min. voltamétrique produisant des conditions sont présentées dans le tableau I ci-dessous. 4. Sauf indication contraire, l'électrolyte utilisé dans tous les cas 0,05 M KF. Le voltamogramme cyclique a été enregistré pour chaque ligand dans une solution sans activateur. Activateur a ensuite été ajouté à la concentration désirée et le voltammogramme cyclique enregistré dans la même gamme de potentiels.
Deux réponses ont été observées, chacun en accord avec l'activation de la réaction de dissolution de l'or. Avec les halogénures et pseudo- (chlorure, bromure, iodure, thiocyanate, malononitrile, et cyanure), une nouvelle vague d'oxydation (pic anodique) apparaît à un potentiel inférieur. Dans certains cas, tels que le thiocyanate, la nouvelle vague chevauche la vague de dissolution dans la solution de ligand sans activateur.
Avec un anion thiosulfate nouvelle vague a été observé, en outre, par l'addition de l'activateur (pyridine) à la solution d'électrolyte est une augmentation importante de courant à un potentiel d'oxydation Au (0) / Au (1). Cet exemple montre sans ambiguïté que la pyridine catalysée la dissolution de l'or dans une solution de thiosulfate.
En résumé, les deux réponses indiquées dans ce tableau sont l'apparition de nouvelles vagues avec cathodique potentiel inférieur à l'Au (0) / Au (1), la solution de ligand et / ou une augmentation significative du courant à ce potentiel. Le type de réponse dépend du type de ligand utilisé dans l'étude. Soit réponse indique une augmentation de la vitesse de dissolution de l'or et par conséquent l'activation du système lixiviant.
Exemple 8.
Effet des composés aromatiques hétérocycliques, sur des électrodes en or dans une solution de cyanure
Cet exemple étudie l'effet de divers composés aromatiques hétérocycliques sur le voltamétrie cyclique d'une électrode en or dans une solution de 0,1 M KCN / 0,1 M KOH. électrode or Vendu était une électrode qui a été broyé avant d'utiliser 6 microns pâte de diamant, lavé avec de l'eau déminéralisée et de l'acétone, imbibé de 30% de peroxyde d'hydrogène et lavé avec de l'eau déminéralisée. Avant de placer l'électrode dans une solution d'une solution de KCN a été complètement désaéré avec de l'azote. voltammogrammes cycliques obtenus à voltammograph BAS CV27 (bioanalytiques Systems, Inc., 2701 Kent Avenue, West Lafayette, IN 47906), en utilisant une électrode de fil de platine et de l'électrode de référence Ag / AgCl. l'électrode en or a été conditionnée par l'application de la tension (-800 mV par rapport à Ag / AgCl) pendant deux minutes, en mélangeant la solution avec un agitateur magnétique. Puis voltamogramme obtenu pour la solution sans agitation d'azote. Test des électrodes a été répété. À ce stade, un composé aromatique hétérocyclique a été ajouté. On a agité la solution pendant 2 minutes typiquement. sans imposer de stress aux activateurs faibles requis une période d'incubation plus longue. Ensuite, la solution a été enregistrée voltammogramme cyclique.
Tableau. La figure 5 montre des solutions d'onde KCN / KOH avec une variété de composés organiques. Pour des activateurs typiques onde dans le -180 à -350 mV (pic 2), qui est absent dans les solutions de KCN / de KOH sans activateur. Dans certains cas, une onde supplémentaire est observée à des potentiels inférieurs (ca. -600 MV). Validation des solutions KCN / KOH montrent seule une vague dans le +200 mV.
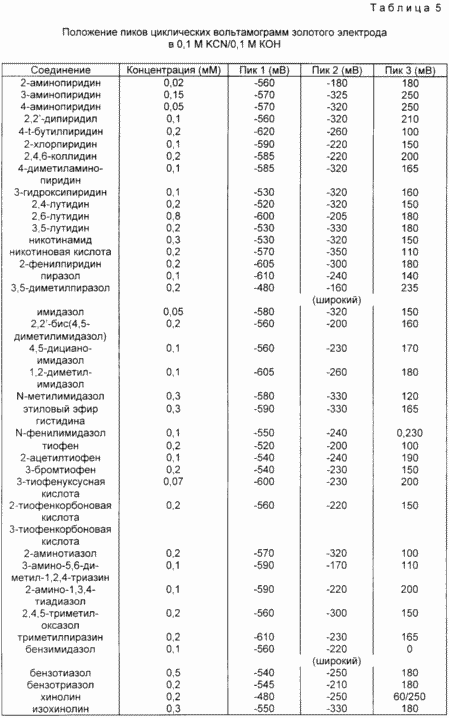
Exemple 9. Effet de l'activateur hétérocyclique électrode en or contenant du soufre dans une solution de thiourée.
Cet exemple montre l'effet de l'activateur de l'acide 3-thiophènecarboxylique sur le voltamogramme cyclique d'une électrode en or dans une solution de thiourée acide. Nous avons utilisé l'équipement électrochimique décrit dans l'exemple 8. Pour la préparation de solutions et de lavage de la verrerie et des électrodes utilisées l'eau d'un système Barnstead Nanopure (Barnstead Thermolyne Corporation, 2555 Kerper Boulevard, Dubuque, IA 52001, USA). Que l'électrode de travail électrode de voltamétrie d'or a été utilisé, une électrode d'argent et d'un fil de platine. Elles sont utilisées comme électrodes de référence et l'électrode de comptage; tous les potentiels sont indiqués par rapport à une électrode d'argent. Toutes les électrodes préparées à partir de (bioanalytiques Systems, Inc., 2701 Kent Avenue, West Lafayette, IN 47907, USA).
Une solution de sulfate de sodium à 0,10 M a été préparée en dissolvant 0,710 g de sulfate de sodium anhydre dans environ 40 ml d'eau dans un bêcher de 50 ml. On a ajusté le pH avec de l'acide sulfurique concentré à 2,5. La solution a été transférée dans une fiole jaugée de 50 ml et on dilue au volume. Cette solution a été utilisée comme électrolyte de support dans l'étude de voltampérométrie cyclique. Un voltamogramme cyclique a été obtenu sous la gamme des capacités allant jusqu'à + 0,400V - 0,400 V; vitesse de balayage dans cet exemple était de 50 mV / s. Le potentiel initial était - 0,20; le potentiel appliqué a été balayé dans la direction anodique de 0,40 V; à ce stade, le balayage a été inversé pour -0,400 V. Pas de vagues ont été observées.
A 10 ml de la solution d'électrolyte-support dans la cellule électrochimique, on a ajouté 0,076 g de thiourée pour donner une solution à 0,10 M. Le voltamogramme cyclique obtenu dans la gamme décrite ci-dessus. Une vague d'oxydation a été observée à environ 0,335 V; dans le sens inverse vague de réduction dans la direction de balayage a été observé à 0,00 V. Ces ondes correspondent à l'oxydation de l'or pour former la restauration de l'or thiourée complexe et le complexe d'or de la thiourée pour former de l'or métallique, respectivement.
0,2 M de solution d'acide 3-thiophènecarboxylique a été préparée en dissolvant 0,380 g dans 25 ml d'éthanol absolu.
A une solution de thiourée dans la cellule électrochimique, on a ajouté 2 ul de la solution ci-dessus d'acide 3-thiophènecarboxylique dans l'éthanol. On a agité la solution pendant environ 30 min. Un voltammogramme cyclique a été obtenu comme décrit ci-dessus. Le courant pour l'onde d'oxydation et des ondes de récupération augmenté, ce qui indique une augmentation de la dissolution de l'or et la réduction du complexe d'or-thiourée, respectivement. des aliquotes supplémentaires d'une solution d'acide 3-thiophènecarboxylique dans de l'éthanol a été ajouté pour obtenir des additions totales de 4, 6 et 8, le MLC; concentrations de solution variaient donc 0,04 - 0,16 mM. Après chaque addition, on a agité la solution pendant 15 à 30 min. Un voltamogramme cyclique a ensuite été obtenue sur la plage potentiel indiqué. vagues d'oxydation et reprise en cours ont augmenté sur la plage de concentration d'activateur de 0,04 à 0,16 mM, indiquant une dissolution accrue de l'or dans la solution d'activateur.
Exemple 10.
Exemples comparatifs de Inactif azote et de soufre hétérocycliques aromatiques Composés
Cet exemple démontre plusieurs composés aromatiques hétérocycliques azotés et de soufre qui ne déclenchent les réactions de dissolution de l'or, en utilisant les modes opératoires décrits ci-dessus. Tableau. 6 les composés inactifs sont répertoriés, et que les méthodes utilisées pour tester l'activité et les résultats obtenus. Exemple 7 voltamétrie cyclique a été utilisé pour démontrer l'apparition d'une nouvelle vague d'oxydation cathodiquement déplacé de la longueur d'onde observée avec le ligand seul. Le ligand utilisé KCI (toutes les solutions ont été préparées comme décrit ci-dessus). Aucune nouvelle vague a été observée, ce qui indique l'inactivité du composé. Exemple 8 a utilisé un M KOH 0,1 M KCN / 0,1 pour démontrer l'activation de la dissolution de l'or dans une solution de cyanure. Les composés actifs donnent une nouvelle vague (Peak 2) cathodiquement déplacé du pic observé dans la solution de ligand. L'absence de cette nouvelle vague indique l'absence d'activation de la réaction de dissolution de l'or.
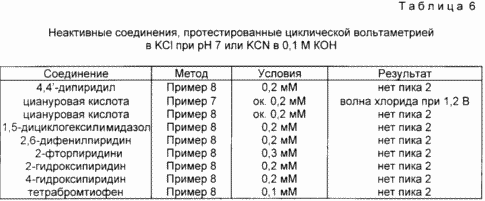
REVENDICATIONS
1. Procédé pour dissoudre le ligand du système d'agent de lixiviation de l'or / oxydant, comprenant l'addition d'une quantité catalytique d'un système de réactif, dans lequel ledit réactif est utilisé en tant que composé hétérocyclique aromatique contenant un atome d'azote cyclique et / ou de soufre, à condition que l'hétéroatome est le soufre et / ou azote, et le noyau hétérocyclique sont disponibles pour la coordination à la surface du métal de l'or non dissous.
2. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est l'ion cyanure avec de l'air ou de l'oxygène dissous.
3. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est un ion chlorure avec l'hypochlorite de sodium à un pH de 8 - 9, le cas échéant en présence d'un stabilisant.
4. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est l'ion bromure avec du brome, éventuellement en présence d'un stabilisant.
5. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est l'ion iodure à l'iode.
6. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est le thiocyanate avec des ions ferriques.
7. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est de la thiourée avec des ions ferriques.
8. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est un anion thiosulfate avec du cuivre, de l'ammoniac et de l'air ou de l'oxygène dissous.
9. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est le malononitrile avec de l'air ou de l'oxygène dissous.
10. Procédé selon la revendication 1, dans lequel la lixiviation du système de ligand / agent oxydant est le cyanure, le chlorure, le bromure, l'iodure, le thiocyanate, le thiosulfate, le malononitrile, ou de la thiourée en présence d'électrode en or chargée.
11. Procédé selon la revendication 1, dans lequel le composé catalytique est un hétérocycle aromatique avec de l'azote et / ou soufre dans le cycle aromatique, qui, lorsqu'il est testé dans un / une solution de KOH 0,1 M contenant 0,1 M KCN une électrode en or, montre une coulométrique d'onde aller de -180 à -350 mV.
12. Procédé selon la revendication 1, dans lequel le composé catalytique est choisi dans le groupe constitué par le 2- (aminométhyl) pyridine, la 2-aminopyridine, 3-aminopyridine, 4-aminopyridine, le 2,2-dipyridyle, le 4,4'-dipyridyle, 2, dipiridilamina-2, la di-2-pyridylcétone 4-butylpyridine, la 2-chloropyridine, la 4-phénylpyridine, la 2-picoline, 3-picoline, 4-picoline, 2-propylpyridine 2,2'-pyridyle, la pyridine, le 3-aminopyrazole 3,5-diméthylpyrazole 4-méthylpyrazole, le 2,4,6-collidine, la 4-diméthylaminopyridine, la 2-éthylpyridine, la 2-fluoropyridine, la 2- (2-hydroxyéthyl) pyridine, la 3-hydroxypyridine, le 2,3-lutidine, 2,4-lutidine, la 2,6-lutidine, 3,5-lutidine, 2-méthoxypyridine nicotinamide acide 2-phénylpyridine, la 3-phénylpyridine, le N-phénylimidazole, le 2-acétylthiophène nicotinique, 3-2,5 bromotiofena -dimetiltiofena, le 2-méthylthiophène, 3-thiophène acide thiophène 2-thiophènecarboxylique 3-méthylthiophène 3-thiophènecarboxylique l'acide 2-thiophèneméthanol 2-aminothiazole 3-amino-5,6-diméthyl-1,2, 4-triazine, le 3-méthylpyrazole, 1-phénylpyrazole pyrazole 1- (3-aminopropyl) imidazole, le 2,2-bis (4,5-diméthylimidazole) ditsianoimidazola-4,5, le 1,2-diméthylimidazole, 2 -etilimidazola, l'histamine, l'ester éthylique de l'histidine, l'imidazole, le N-metiltimidazola, le 2-méthylimidazole, le 4-méthylimidazole, le benzothiazole, le benzotriazole, l'isoquinoléine, la 1,10-phénanthroline, la quinoléine 2-aminobenzimidazole 2-aminoimidazole, aminopyrazine, 2-aminopyrimidine 2-amino-4,6-diméthylpyrimidine, la 2,6-diamino pyridine, la L-histidine, 2-amino-1,3,4-triadiazola, 2,4,5-trimetiloksazola, trimetilpirazina, le benzimidazole, la DL-histidine, la pyrazine , tétraméthylpyrazine, trimetilpirazina.
13. Procédé selon la revendication 1, dans lequel le composé catalytique est choisi dans le groupe constitué par l'imidazole, le N-méthylimidazole, le benzimidazole, la pyridine, la picoline (2-, 3- et 4), la lutidine (2,3-; 2,4-; 2,6-, 3,5-), la collidine, la quinoléine, isoquinoléine, thiophène, 3-thiophènecarboxylique, l'acide 3-thiophène, aminopyridine, la 3-hydroxypyridine, la diméthylaminopyridine, le thiazole, le méthylthiazole, diméthylthiazole, pyrazine, 3-amino-5 6-diméthyl-1,2,4-triazine, le pyrazole, le 3,5-diméthylpyrazole, l'acide nicotinique, ditsianoimidazola, 2,4,5-trimetiloksazola, le 2-amino-1,3,4-thiadiazole, le L-histidine et 2 -aminopirimidina.
14. Procédé selon la revendication 2, dans lequel le système un pH d'environ 9 ou plus, une concentration en cyanure d'environ 10 moles ou moins, et le composé catalytique est choisi dans le groupe constitué par l'imidazole, le N-méthylimidazole, le 1,2-diméthylimidazole, la pyridine, l'alpha, bêta -, la gamma-picoline, 2-, 3-, 4-aminopyridine, la 4-diméthylaminopyridine, le thiophène, l'acide 3-thiophènecarboxylique, l'acide 3-thiophène, pyrazine, 2,4,6-trimetiltriazina, le thiazole, la L-histidine et le 2- aminopyrimidine.
15. Procédé selon la revendication 3, dans lequel le pH du système à propos de 8 - 9 et le composé catalytique est choisi dans le groupe constitué par la pyridine, alpha-, bêta-, gamma-picoline, la di-2-pyridylcétone, le 2,2-dipyridyle, 3, 5-lutidine, la 2,6-lutidine, la 2,3-lutidine, la N-méthylimidazole, la L-histidine et de 2-aminopyrimidine.
16. Procédé selon la revendication. 4, où le système pH d'environ 9 ou plus et le composé catalytique est choisi dans le groupe constitué par la pyridine, alpha-, bêta-, gamma-picoline, la di-2-pyridylcétone, le 2,2'-dipyridyle, 3 5-lutidine, la 2,6-lutidine, la 2,3-lutidine et le N-méthylimidazole.
17. Procédé selon la revendication 6, dans lequel le système pH à environ 2-3.
18. Procédé selon la revendication 1, dans lequel le composé catalytique est de l'acide 3-thiophènecarboxylique.
19. Procédé selon la revendication 8, dans lequel le thiosulfate est présent dans la plage allant de 0,1 à 0,25 mole d'ions cuivre (II) est présent dans la gamme de 0,01 à 0,15 mol, de l'ion ammonium (comme le thiosulfate, l'hydroxyde et sulfate) présent dans l'intervalle de 0,5 à 4,8 mole, et le composé catalytique est choisi dans le groupe constitué par la pyridine, alpha-, bêta-, gamma-picoline, la di-2-pyridylcétone, le 2,2-dipyridyle, le 3,5-lutidine, la 2 , 6-lutidine, la 2,3-lutidine, l'imidazole, le N-méthylimidazole, le thiophène, l'acide 3-thiophènecarboxylique, l'acide, la pyrazine, la 2,4,6-trimetiltriazina, le thiazole, la L-histidine-3 thiophène et 2-aminopyrimidine.
20. Procédé selon la revendication 9, dans lequel le pH du système d'environ 10 - 12.
Version imprimable
Date de publication 14.03.2007gg




Commentaires
Commentant, gardez à l' esprit que le contenu et le ton de vos messages peuvent blesser les sentiments des gens réels, montrer du respect et de la tolérance à ses interlocuteurs, même si vous ne partagez pas leur avis, votre comportement en termes de liberté d'expression et de l' anonymat offert par Internet, est en train de changer non seulement virtuel, mais dans le monde réel. Tous les commentaires sont cachés à l'index, le contrôle anti - spam.